
Anvisa aprova primeiro autoteste para Covid-19 no Brasil
:format(webpp))
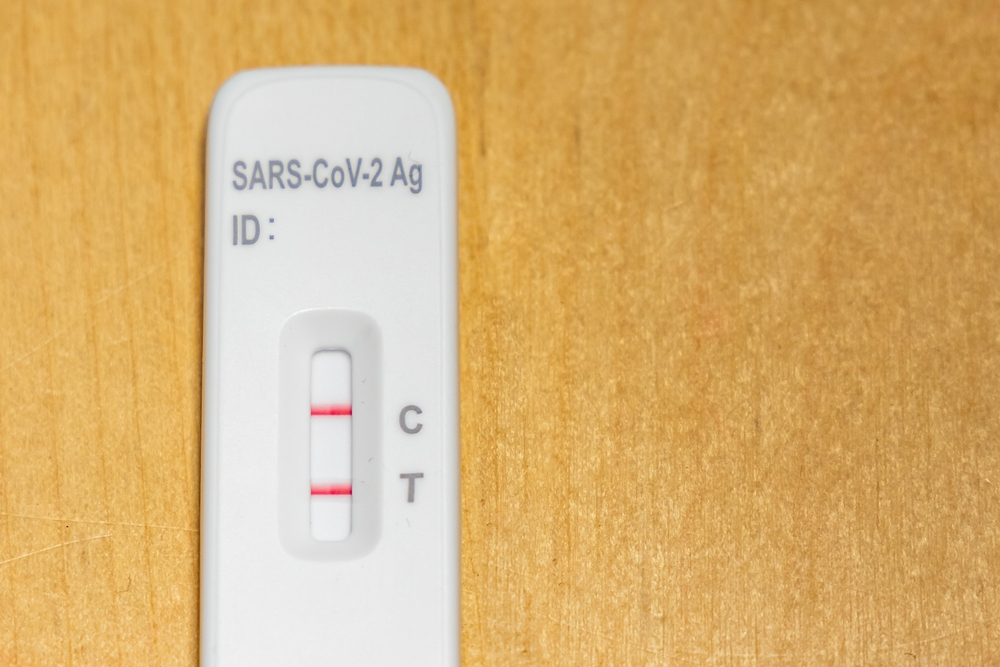
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do primeiro autoteste para Covid-19 no país. O produto foi nomeado de “Novel Coronavírus Autoteste Antígeno”, fabricado pela empresa CPMH Comércio e Indústria de Produtos Médicos-Hospitalares e Odontológicos. O primeiro autoteste aprovado usa um swab nasal (uma espécie de cotonete) e dá o resultado após 15 minutos.
De acordo com a agência, ainda não há um prazo para os autotestes começarem a ser comercializados: “A disponibilidade do produto no mercado depende da empresa detentora do registro”, informou em nota.
A avaliação do pedido de registro na Anvisa levou 16 dias, incluindo quatro utilizados pela empresa solicitante para atender exigências técnicas feitas pela agência reguladora. “A Anvisa analisa uma série de requisitos técnicos, entre os quais estão a usabilidade e o gerenciamento de risco, que servem para adequar o produto para uso por pessoas leigas dando maior segurança no seu uso”, diz a agência em comunicado.
Leia mais: Anvisa libera venda de autotestes de Covid-19 no Brasil
Como vai funcionar o primeiro autoteste?
O autoteste é parecido com o teste rápido, mas pode ser feito em casa, por qualquer pessoa. Dessa forma, o kit contém um dispositivo de teste, tampão de extração, filtro e o swab (uma espécie de cotonete usado para a coleta nasal).
O chamado “teste de antígeno” é capaz de identificar o antígeno viral, que é uma estrutura do vírus que faz com que o corpo produza uma resposta imunológica contra ele (os anticorpos). Se ele dá positivo, significa que a pessoa está infectada no momento do teste.
Ainda segundo a ANVISA, é indicado utilizar o autoteste “entre o 1º e o 7º dia do início de sintomas como febre, tosse, dor de garganta, coriza (popularmente conhecida como nariz escorrendo), dores de cabeça e no corpo”.
“Caso você não tenha sintomas, mas tiver tido contato com alguém que testou positivo, aguarde cinco dias antes de usar o autoteste. O autoteste não define um diagnóstico, o qual deve ser realizado por um profissional de saúde. Seu caráter é orientativo, ou seja, não se trata de um atestado médico”, informou a agência.
Além do primeiro autoteste, agência avalia outros pedidos
A Anvisa autorizou o uso de autotestes de Covid-19 no Brasil no final de janeiro. Com a aprovação, fica permitida a venda dos exames por farmácias e estabelecimentos de saúde licenciados para comercializar dispositivos médicos.
Além da empresa responsável pelo primeiro autoteste, outras 67 fizeram pedidos de registro à Anvisa. Porém, dez tiveram o registro reprovado, enquanto outras duas estão “em análise do cumprimento de exigência”, uma das últimas etapas antes de possível aprovação.
Requisitos para o registro
Entre os requisitos para conceder o registro, a Anvisa determina que os produtos devem apresentar instruções de uso, armazenagem e descarte. Além disso, as informações precisam contar com uma linguagem simples e com ilustrações, para facilitar o manuseio e a interpretação do resultado.
Com relação à embalagem, as orientações informam que o rótulo externo do produto deve conter todos os componentes do kit que são necessários para a realização do teste, além da validade do dispositivo. Além disso, o fabricante deve oferecer um canal de atendimento ao usuário para orientar e encaminhar as demandas sobre o uso do produto e como proceder após a obtenção do resultado.
Segundo a Anvisa, além de disponibilizar o contato desse serviço de atendimento, a empresa deve indicar o serviço Disque Saúde do Ministério da Saúde, de acordo com as recomendações do Plano Nacional de Expansão da Testagem para Covid-19, o PNE-Teste.
Fontes: CNN e G1.

:format(webpp))
)

